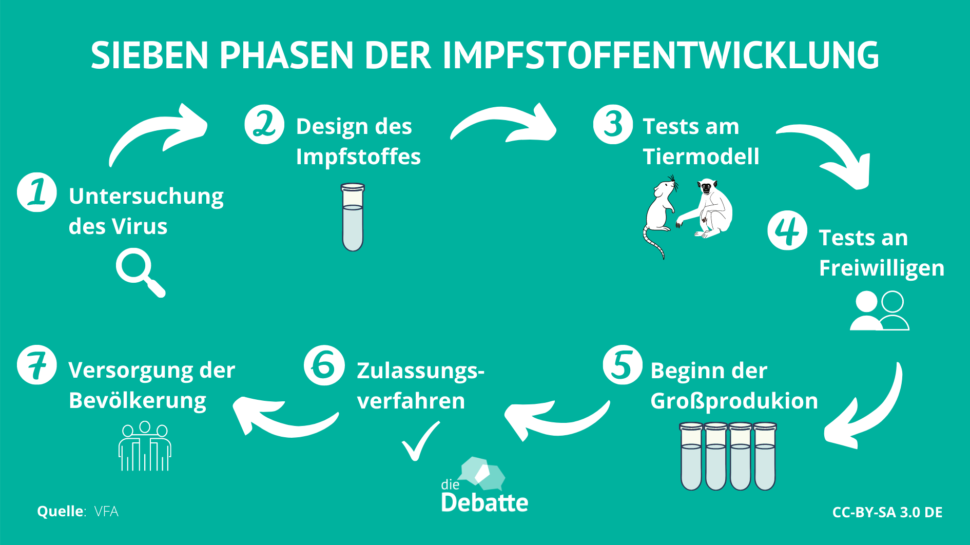
Rasante Impfstoffentwicklung
Dass die Entwicklung und Zulassung der Impfstoffe derzeit so schnell vorangeht, hat gleich mehrere Gründe: Derzeit fließt sehr viel Geld in die Impfstoffforschung. Bei Herstellern sinkt das Risiko auf den Entwicklungskosten sitzen zu bleiben. Daneben hat die EMA die Impfstoffzulassung auf ihre Prioritätenliste gesetzt. Die Behörden versuchen bürokratische Abläufe zu verkürzen und prüfen die Daten parallel während die Studien noch laufen. Außerdem finden die Wissenschaftler*innen während einer Pandemie schneller Studienteilnehmer*innen. Viele Forschungsgruppen weltweit können zudem auf Vorerfahrungen aus der Impfstoffentwicklung gegen die Coronaviren SARS und MERS zurückgreifen. Auch die Sequenz von SARS-CoV-2 war schnell bekannt: Bereits im Januar haben chinesische Wissenschaftler*innen das virale Genom entschlüsselt und online veröffentlicht.
So ist es möglich, dass das PEI bereits zum Ende 2020 oder Anfang 2021 erste Ergebnisse aus den Phase-III-Studien für einige Kandidaten erwartet und auf Anfrage schriftlich mitteilte, dass es im Falle einer positiven Nutzen-Risiko-Bewertung damit rechnet, „dass die Europäische Kommission eine Zulassung erteilt, möglicherweise schon Anfang kommenden Jahres”. Damit wäre ein normalerweise Jahre oder Jahrzehnte andauernder Prozess innerhalb knapp eines Jahres abgeschlossen.
Mehr als ein zugelassener Covid-19-Impfstoff möglich
Dabei ist es wahrscheinlich, dass es aufgrund der großen Zahl an Impfstoffkandidaten am Ende mehr als einen zugelassenen Impfstoff geben wird. „Man muss natürlich auch bedenken, dass es wahrscheinlich nicht einen Impfstoff gibt, der für alle einen Schutz hervorruft. Da gibt es jetzt die Chance, durch die vielen verschiedenen Impfstoffkandidaten, zu schauen, welcher Impfstoff für welche Teile der Bevölkerung am passendsten ist. Da können wir ein wenig in die Richtung personalisierte Medizin gehen”, sagt Dahlke. Es wäre ein großer Fortschritt, wenn Ärzt*innen Vakzine auswählen könnten, die beispielsweise den besten Schutz bei Kindern, Älteren, Gesunden oder Menschen mit Vorerkrankungen bieten.
Allerdings ist die Zulassung eines Impfstoffs nicht mit dem Ende der Pandemie gleichzusetzen. „Die Zulassung eines Impfstoffs heißt nicht, dass dieser sofort für die gesamte Bevölkerung zur Verfügung stehen wird”, heißt es aus dem PEI. Deshalb entwickelt die Ständige Impfkommission (STIKO) am RKI eine Empfehlung, welche Bevölkerungsgruppen in Deutschland zuerst geimpft werden sollen. „Dazu gibt es auch schon Modellberechnungen, die sagen können: Wenn diese Populationen als erstes geimpft wird, könnte dies zum Beispiel einen wichtigen Beitrag zur Eindämmung der Pandemie leisten”, so Dahlke.
Jedoch bleibt abzuwarten, wie lange die Impfstoffe schützen werden und ob sie auch eine Ansteckung mit dem Coronavirus verhindern können. „Ich glaube auch, dass die Impfstoffe, die zuerst zugelassen werden, noch nicht optimal sein werden“, sagt Ulbert. Seiner Einschätzung nach werden die Impfstoffe der ersten Generation wahrscheinlich vor allem Symptome mildern und vor schweren Verläufen schützen können. Allerdings schlage ausgerechnet bei älteren Menschen eine Impfung oft schlechter an, denn ihr Immunsystem ist weniger leistungsstark. „Man möchte natürlich trotzdem bestimmte Risikogruppen schützen, bei denen der Impfstoff nicht ausreichend funktioniert, oder die man nicht impfen kann. In diesem Fall wäre natürlich ein Impfstoff schlecht, der zwar die Geimpften vor Krankheiten schützt, aber es nicht schafft, das Virus komplett zu eliminieren. Da wird eine Evolution stattfinden, es wird Nachfolgeprodukte mit besserer Wirksamkeit geben“, so Ulbert.
Hürden nach der Zulassung
Eine der größten Herausforderungen, bei der Versorgung der Bevölkerung mit einem potenziellen Impfstoff, ist es diesen in großen Mengen zu produzieren, aufzubewahren und dann zu verteilen. Das Bundesforschungsministerium hat deswegen ein 750 Millionen Euro schweres Sonderprogramm aufgelegt, um die Entwicklungs- und Produktionskapazitäten in Deutschland auszubauen. Das ist insbesondere deshalb notwendig, weil Wissenschaftler*innen derzeit davon ausgehen, dass jeder Einzelne für einen dauerhaften Schutz zweimal geimpft werden müsse. Bei einer Weltbevölkerung von knapp 7,8 Milliarden Menschen bedeutet das 15,6 Milliarden Impfdosen, die es zu verteilen gilt. Geht es nach der COVAX-Initiative, soll dies möglichst fair geschehen. Der Plan der Impfallianz GAVI (Global Alliance for Vaccines and Immunisation), der WHO und der Forschungsallianz CEPI (Coalition for Epidemic Preparedness Innovations) sieht vor, dass wohlhabende Staaten den Covid-19-Impfstoff kaufen und ihn an Länder weitergeben, die ihn sich sonst nicht leisten könnten. Ob dies gelingt, wird von Expert*innen unterschiedlich eingeschätzt. Fakt ist: Schon heute haben sich einige Länder Hunderte Millionen Dosen Impfstoff gesichert und das, obwohl diese noch gar nicht auf dem Markt sind.
 Fleisch aus dem Labor
Fleisch aus dem Labor  CO2-Speicherung
CO2-Speicherung  Biodiversität
Biodiversität  Fracking
Fracking  Dürre
Dürre  Pränataldiagnostik
Pränataldiagnostik  Ernährungssicherung
Ernährungssicherung  Energiesicherheit
Energiesicherheit  Quantentechnologien
Quantentechnologien  Kinderarmut
Kinderarmut  Kosten des Klimawandels
Kosten des Klimawandels  Wahlverhalten
Wahlverhalten  Nudging
Nudging  Kryptowährung und Blockchain
Kryptowährung und Blockchain  Genchirurgie
Genchirurgie  Debattenkultur
Debattenkultur  Impfstoffverteilung
Impfstoffverteilung  Corona
Corona  Atomendlager
Atomendlager  Weltraumnutzung
Weltraumnutzung  Drohnen
Drohnen  Gedenkkultur
Gedenkkultur  Medikamentenentwicklung
Medikamentenentwicklung  Organspende
Organspende  Kriminalität
Kriminalität  Krankenhaus
Krankenhaus  Cannabis
Cannabis  Künstliche Intelligenz
Künstliche Intelligenz  Feinstaub
Feinstaub  Geoengineering
Geoengineering  Intelligenz
Intelligenz  Wohnungsmarkt
Wohnungsmarkt  Plastikmüll
Plastikmüll  Digitalisierte Kindheit
Digitalisierte Kindheit  Frieden
Frieden  Meinungsforschung
Meinungsforschung  Alzheimer
Alzheimer  Bienensterben
Bienensterben  E-Zigarette
E-Zigarette  Social Bots
Social Bots  Autonomes Fahren
Autonomes Fahren  Flucht und Migration
Flucht und Migration