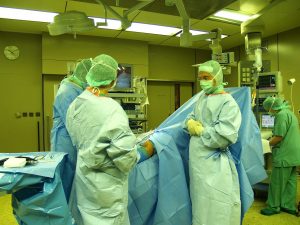
Zumindest das Potenzial, dereinst Menschenleben zu retten, hat die Xenotransplantation aber schon heute, glaubt Angelika Schnieke, in deren Laboratorien immer mehr Erbanlagen in Schweinen vermenschlicht werden, um die Immunabwehr der Organempfänger zu besänftigen: „Experimente haben ja bereits gezeigt, dass mehrfach transgene und transplantierte Schweineherzen in nicht-menschlichen Primaten drei Monate überleben.” Das hieße, es gäbe bereits beim heutigen Stand der Xenotransplantation die Möglichkeit, beispielsweise beim „Eintritt eines plötzlichen Herzversagens vorübergehend ein Schweineherz zu implantieren, bis ein menschlicher Spender gefunden ist.”
Was weiterhin fehlt, sei eine Übereinkunft, wann welche Experimente einer Xenotransplantation mit soliden Schweineorganen erlaubt werden sollten: „Es gibt momentan, auf rechtlicher Ebene Regelungsbedarf, insbesondere für die Xenotransplantation von Organen in Europa”, sagt Ralf Tönjes. Es würden aber derzeit bereits Gespräche geführt, um die Rechtslücken schnellstmöglich zu schließen. Grundsätzlich sieht Tönjes einer ersten Anwendung der neuen Methoden der Xenotransplantation durchaus optimistisch entgegen. Es sind jedoch noch Detailfragen im Rahmen der Arzneimittelregulation zu klären.
Wenn an die bereits erreichten Erfolge beim Überleben der Schweineorgane in Affen mit einer weiter optimierten Generation von transgenen Schweinen angeknüpft werden könne, dann müsse man auf erste klinische Experimente vielleicht nicht mehr lange warten. „Es muss jetzt zunächst gezeigt werden, dass die bisherigen Erfolge wiederholt werden können”, glaubt auch Angelika Schnieke. „Als nächstes wird es Experimente mit Schweinen geben, die noch mehr genetische Modifikationen haben, sodass erste Transplantationen eventuell in fünf Jahren bereits durchgeführt werden können.”
 Fleisch aus dem Labor
Fleisch aus dem Labor  CO2-Speicherung
CO2-Speicherung  Biodiversität
Biodiversität  Fracking
Fracking  Dürre
Dürre  Pränataldiagnostik
Pränataldiagnostik  Ernährungssicherung
Ernährungssicherung  Energiesicherheit
Energiesicherheit  Quantentechnologien
Quantentechnologien  Kinderarmut
Kinderarmut  Kosten des Klimawandels
Kosten des Klimawandels  Wahlverhalten
Wahlverhalten  Nudging
Nudging  Kryptowährung und Blockchain
Kryptowährung und Blockchain  Genchirurgie
Genchirurgie  Debattenkultur
Debattenkultur  Impfstoffverteilung
Impfstoffverteilung  Corona
Corona  Atomendlager
Atomendlager  Weltraumnutzung
Weltraumnutzung  Drohnen
Drohnen  Gedenkkultur
Gedenkkultur  Medikamentenentwicklung
Medikamentenentwicklung  Organspende
Organspende  Kriminalität
Kriminalität  Krankenhaus
Krankenhaus  Cannabis
Cannabis  Künstliche Intelligenz
Künstliche Intelligenz  Feinstaub
Feinstaub  Geoengineering
Geoengineering  Intelligenz
Intelligenz  Wohnungsmarkt
Wohnungsmarkt  Plastikmüll
Plastikmüll  Digitalisierte Kindheit
Digitalisierte Kindheit  Frieden
Frieden  Meinungsforschung
Meinungsforschung  Alzheimer
Alzheimer  Bienensterben
Bienensterben  E-Zigarette
E-Zigarette  Social Bots
Social Bots  Autonomes Fahren
Autonomes Fahren  Flucht und Migration
Flucht und Migration